Titulação
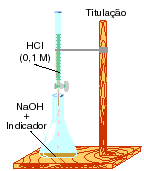 |
É o método pelo qual
se determina uma quantidade desconhecida de uma
substância particular, mediante a adição de um
reativo-padrão que reage com ela em proporção definida
e conhecida. A adição de um reativo-padrão (um reativo
de concentração conhecida e freqüentemente designado
como reativo-titulado) se regula e se mede de alguma
maneira, requerendo-se um método de indicaçào para
saber quando a quantidade do reativo normal juntado é
precisamente a suficiente para reagir quantitativamente
com a substância que se determina. Por
conseguinte,conhecendo a proporção em que reagem as
substâncias e tendo determinado aquantidade de uma
substância (o reativo titulado)necessária para reagir
nesta proporção, pode-se calcular facilmente a
quantidade desconhecida de substância presente no frasco
da reação. |
Em uma titulação, o ponto em
que a quantidade de reativo titulado adicionado é exatamente a
suficiente para que se combine em uma proporção
estequiométrica, ou empiricamente reproduzível com a
substância que se determina , chama-se ‘ponto de
equivalência’. O ponto final de uma titulação deve
coincidir com o ponto de equivalência ou estar muito próximo
dele. A diferença entre os pontos de equivalência e final se
chama intervalo do indicador.
As titulações se realizam
quase sempre com soluções ou dissoluções, porém também é
fácil realizá-las com substâncias nos estados gasoso, sólido
e de fusão, se se dispõe de um equipamento adequado.
Exemplo: Vejamos
como é feita a titulação da solução de ac. Sulfúrico de
concentração X mol/L por meio de uma solução de hidróxido de
sódio de concentraçao 0,10 mol/L.
1 parte) Por meio de uma pipeta
ou de uma buretamedimos o volume de 25,00mL da soluçao de ac.
Sulfúrico e transferimos essa solução para um erlenmeyer,
adicionando algumas gotas de solução alcoólicas de
fenolftaleína, que ira atuar como indicador. A solução no
erlenmeyer ficará incolor, pois a fenolftaleína em meio ácido
permanece incolor.
2 parte) Colocamos a solução
de hidróxido de sódio de concentração 0.10 mol/L no interior
de uma bureta e fazemos o nível dessa solução coincidir com o
zero da bureta. Agora, iniciamos a titulação propriamente dita.
Gotejamos a solução de hidróxido de sódio no interior do
erlenmeyer, sob agitação continua. À medida que a solução de
hidróxido de sódio vai sendo introduzida no frasco, a
quantidade de ac. Sulfúrico no seu interior vai diminuindo,
porque há neutralização do ácido pela base.
3 parte) Enquanto houver ac.
Sulfúrico no erlenmeyer, a solução no seu interior
permanecerá incolor. Num dado instante, ao cair uma gota de
hidróxido de sódio no erlenmeyer , a solução ficará
avermelhada. Nesse instante fecha-se a torneira da bureta e esta
terminada a titulação.
A última gota de NaOH que caiu
contem excesso de NaOH, pois apareceu a coloração avermelhada,
porém esse excesso é desprezível. Qiando a solução passa de
incolor a avermelhada , significa que o ac. sulfúrico reagiu
completamente com o NaOH (fim da titulação)
Volume de NaOH gasto na
titulação: 22,50 mL. Portanto, 25,00 mL de sol. De ac.
Sulfúrico de concentração X mol/L exigiram na titulação
22,50 mL de NaOH de concentração 0.10 mol/L.
